Elektrokimia adalah cabang ilmu kimia fisik yang mempelajari aspek kelistrikan dari reaksi kimia. Dalam aplikasi di otomotif, elektrokimia dapat ditemui dalam sebuah baterai.
Baterai Lead acid
Selain secara elektromagnetik, listrik pada kendaraan juga diperoleh dari proses elektrokimia pada baterai. Baterai lead-acid adalah perangkat elektrokimia yang menghasilkan tegangan dan memberikan arus listrik. Baterai adalah “sumber” utama energi listrik yang digunakan di kendaraan saat ini. Penting untuk diingat bahwa baterai tidak menyimpan listrik, melainkan menyimpan serangkaian bahan kimia, dan melalui proses kimia itulah listrik diproduksi. Pada dasarnya, dua jenis timbal dalam campuran asam bereaksi untuk menghasilkan tegangan listrik. Reaksi elektrokimia ini mengubah energi kimia menjadi energi listrik dan merupakan dasar untuk semua baterai otomotif.
Baterai mobil mengandung elektrolit asam sulfat encer dan beberapa pelat elektroda positif dan negatif. Karena pelat terbuat dari bahan timbal, jenis baterai ini sering disebut baterai asam timbal (lead-acid). Baterai dipisahkan menjadi beberapa sel (biasanya enam untuk baterai mobil), dan di setiap sel terdapat beberapa elemen baterai, semua dicelupkan dengan larutan elektrolit.
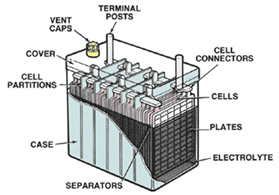
Gambar 1 Konstruksi baterai
Dua logam berbeda yang ditempatkan dalam bak asam menghasilkan potensial listrik di kutub-kutubnya. Sel menghasilkan tegangan dengan reaksi kimia antara pelat dan elektrolit. Plat positif terbuat dari bahan Lead Dioxide (PBO2) sedangkan plat negatifnya terbuat dari bahan Sponge Lead (PB).
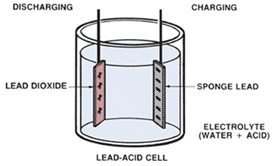
Gambar 2 Elektroda baterai
Baterai menyimpan listrik dalam bentuk energi kimia. Melalui proses reaksi kimia, baterai membangkitkan dan melepaskan listrik sesuai kebutuhan oleh sistem atau perangkat listrik. Karena baterai kehilangan energi kimianya dalam proses ini, baterai harus diisi ulang oleh alternator. Dengan membalik aliran arus listrik pada baterai, proses kimia dibalik, sehingga terjadi pengisian daya baterai. Siklus pemakaian dan pengisian diulang terus menerus dan disebut “battery cycling”.
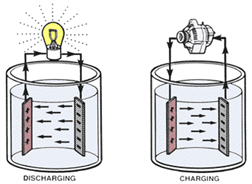
Gambar 3 Siklus pengosongan dan pengisian baterai
Reaksi Kimia Pada Saat Discharging
Yang dimaksud discharging adalah penggunaan isi (kapasitas) baterai. Rekasi kimia yang terjadi ialah:
PbO2+ 2 H2SO4 + Pb —> PbSO4 + 2 H2O + PbSO4
Pada akhir discharging, plat positif dan plat negatif akan menjadi PbSO4 dan elektrolitnya akan menjadi H2O.
Reaksi Kimia Pada Saat Recharging
Yang dimaksud recharging adalah proses pengisian baterai. Reaksi kimia yang terjadi ialah:
PbSO4 + 2 H2SO4 + PbSO4 —> PbO2 + 2 H2SO4 + Pb
Akhir dari proses recharging ini, plat positif kembali menjadi PbO2 dan plat negatifnya Pb, sedangkan elektrolit kembali terbentuk menjadi H2SO4.
Berat jenis adalah salah satu parameter untuk sebuah kapasitas baterai. Sebuah “Hydrometer” atau “Refractometer” membandingkan berat elektrolit dengan air. Elektrolit dalam baterai yang terisi lebih kuat dan lebih berat daripada elektrolit dalam baterai bekas. Elektrolit dalam baterai terisi penuh adalah sekitar 36% asam dan 64% air. Berat jenis air adalah 1.000, dan berat jenis asam sulfat adalah 1,835, yang berarti asam 1,835 kali lebih berat daripada air. Berat jenis elektrolit untuk baterai penuh adalah 1,270.
Selain baterai lead-acid, saat ini telah banyak digunakan sealed battery (free maintenance battery). Keuntungan utama dari sealed battery adalah tidak memancarkan gas korosif selama penggunaan atau pengisian. Tidak seperti baterai basah, sealed battery tidak akan menumpahkan asam. Sealed battery tidak memiliki tutup yang dapat dilepas yang memungkinkan Anda mengisi kembali elektrolit. Namun, sealed battery memiliki katup pengatur tekanan aktif yang terbuka hanya jika terjadi overheating. Baik baterai lead-acid maupaun sealed battery, dalam kendaraan adalah sama, mereka berfungsi untuk mengubah energi kimia menjadi energi listrik.
Baterai Maintenance Free (MF)
Baterai MF (Maintenance Free) juga adalah lead-acid battery hasil pengembangan dari baterai biasa untuk melindungi agar elektrolit tidak berkurang karena reaksi gas yang dibangkitkan dari self-discharge atau reaksi kimia, dan mengurangi proses perawatan dan pemeriksaan. Keunggulan battery MF adalah sebagai berikut:
- Tidak perlu melakukan pemeriksaan atau mengganti air sulingan.
- Self-discharge sangat kecil.
- Dapat disimpan dalam jangka waktu yang lama.
Perbedaan mendasar antara baterai MF dan baterai biasa adalah pada material, metode pembuatan dan bentuk grid. Material untuk grid adalah campuran lead-antimony yang mempunyai antimony (Sb) sedikit atau campuran lead-calcium. Antimony, digunakan pada grid baterai biasa, bahan ini digukanan untuk meningkatkan kekuatan mekanis pada grid dan agar proses pembuatan oleh pabrik menjadi lebih mudah.
Baterai MF terbuat dari bahan campuran terdiri dari sedikit antimony atau lead-calcium, maka pengurangan elektrolit dan self-discharge akan terhindari. Metode pembuatan untuk grid adalah dengan membuat susunan pelat besi melalui proses mekanikal seperti tempaan lembaran baja, sehingga kualitas dan produktivitasnya meningkat. Dengan memakai sebuah catalyst plug untuk memisahkan oxygen dan hydrogen ke air suling, tidak perlu ada lagi penambahan air suling pada baterai MF.
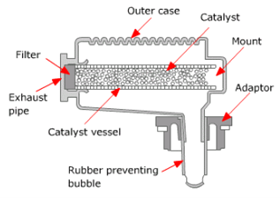
Gambar 4 Struktur catalist plug

Gambar 5 Baterai biasa (kiri) dan baterai MF (kanan)
Baca Juga:
- Teori Dasar Listrik
- Besaran Listrik
- Pengukuran Besaran Listrik
- Hukum Kirchhoff
- Wheatstone bridge
- Elektromagnetik dan Aplikasinya
Referensi:
Setiyo, M. (2017) Listrik & Elektronika Dasar Otomotif (Basic Automotive Electricity and Electronics). Edited by A. Burhanudin. Magelang: UNIMMA Press.